En la entrada anterior empezamos a hablar de las propiedades periódicas de los elementos pero no lo finalizamos ahora explicaremos las dos ultimas que vamos a mencionar
- Energía de Ionización (EI): es la energía necesaria que hay que comunicar a un átomo neutro gaseoso en su estado fundamental para arrancarle un electrónconvirtiéndolo en un Catión (anión positivo).
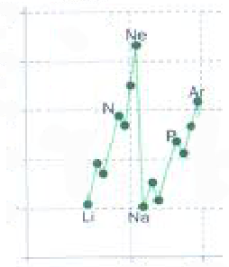
Al desplazarnos hacia la derecha la EI crece en lineas generales (aunque hay algunas excepciones) esto se debe a que los electrones se encuentran cada vez mas cerca del núcleo, haciendo que sea cada vez mas difícil arrancarlos por la misma razón decrece al descender en un grupo ya que el tamaño va aumentando.
Algunas de esas excepciones son:
las anomalías observadas en la gráfica se explica de la siguiente forma:
El berilio es más estable porque tiene todas sus subniveles completos, por eso tiene mas energía.
- Electroafinidad: es la energía puesto en juego cuando un átomo neutro gaseoso en su estado fundamental toma un electrón convirtiéndose en un anión (ion negativo)
La afinidad electrónica suele ser positiva es una energía desprendida aunque a veces puede ser negativa en caso de átomo muy electropositivos.
En la tabla periódica la AE crece hacía la derecha y en el grupo crece hacia arriba.


Comentarios en: "Propiedades periódicas de los elementos (ionización y electroafinidad)" (2)
Aqui te dejo una presentacion sobre el tema:
Esta presentación tambien va en la línea: